ジェネリック医薬品とは?
おくすりは、下の図に示されるように「医療用医薬品」と「一般用医薬品」の2つに分けられ、医療用医薬品は、医師の診断によって処方されるおくすりのことで、患者さんが自由に購入することはできません。 これに対して一般用医薬品は、いわゆる市販薬(大衆薬・OTC ※ とも呼ばれる)のことで、ドラッグストア・薬局などで処方せん無しで購入できるおくすりです。※ OTC・・・Over The Counter Drugの略。薬局のカウンター越しに買えるおくすりという意味。
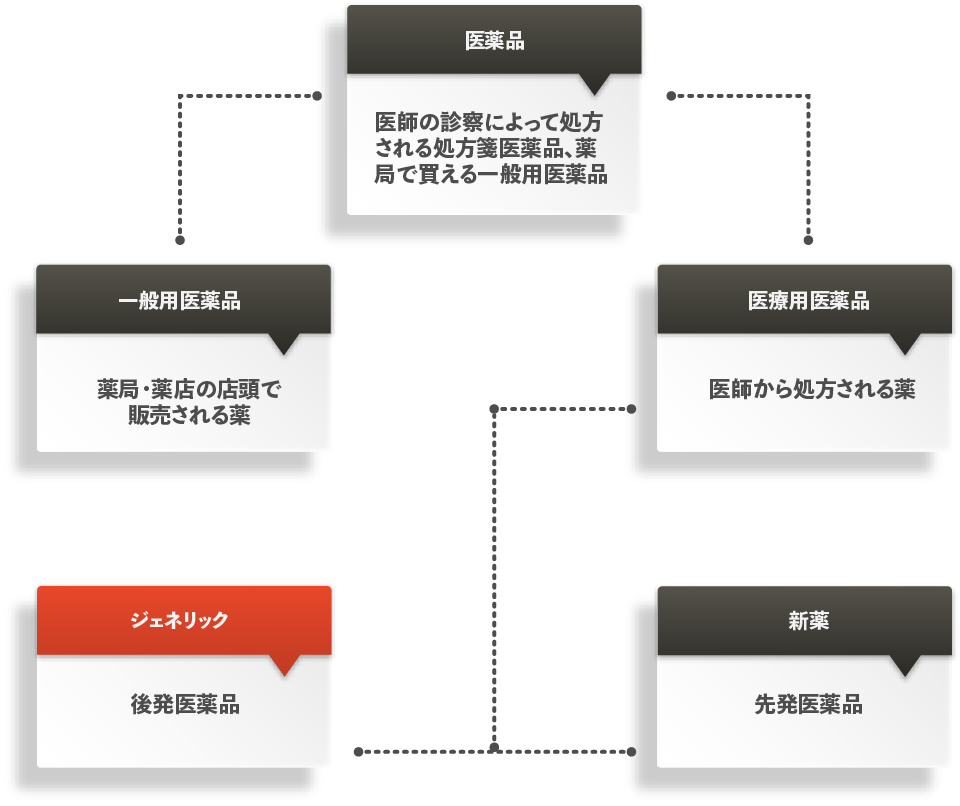
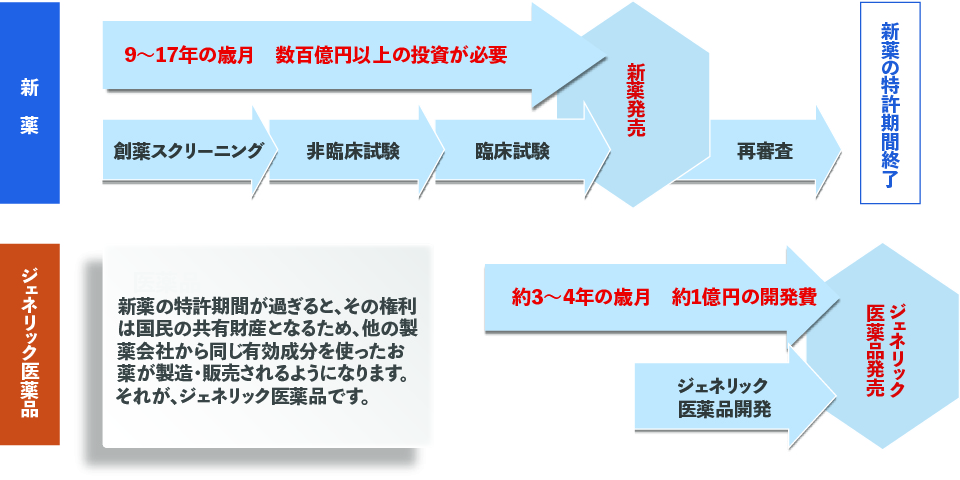
さらに、医療用医薬品は「新薬(先発医薬品)」と「ジェネリック医薬品(後発医薬品)」に分けられます。 新薬は、9~17年もの歳月と、数百億円以上の費用をかけて開発されるので、開発した製薬会社は、特許の出願によりその期間、そのおくすりを独占的に製造・販売する権利が与えられます。 しかし、特許期間が過ぎると、その権利は国民の共有財産となるため、他の製薬会社から同じ有効成分を使ったおくすりが製造・販売できるようになります。それが、ジェネリック医薬品です。新薬に比べ開発費や開発期間が少ないために、新薬より低価格でご提供できます。